聽(tīng)說(shuō)這幫科學(xué)狂人要通過(guò)清除體內(nèi)「老不死的」細(xì)胞讓人保持青春!
11月8日
科學(xué)狂人團(tuán)隊(duì)開(kāi)發(fā)了一類名為“senolytics”的藥物津畸,能夠有針對(duì)性地清除體內(nèi)導(dǎo)致老年病的衰老細(xì)胞振定,延緩疾病的發(fā)生或者減輕疾病的癥狀必怜。
為了延緩衰老,古有求仙問(wèn)道城汹,煉丹服藥偷菩,今有基因編輯,換血養(yǎng)生拄下。本奇點(diǎn)糕覺(jué)得咳蚣,長(zhǎng)生不老目前還是太遙遠(yuǎn)的一件事情,或許需要人類再花上幾十年鸳咐、幾百年去研究嘁拖,甚至也可能根本就是一場(chǎng)鏡花水月。
所以比起這些泥觉,本糕還是更關(guān)心瘸利,如何才能健康地、有尊嚴(yán)地老去紊捉?
想到老了之后骨關(guān)節(jié)炎可能會(huì)找上門(mén)怯路,行動(dòng)不再自如了;
阿爾茨海默病可能會(huì)找上門(mén)溯剑,記性不好了蛉加,生活不能自理了;
心臟病也可能會(huì)找上門(mén)因宇,體力活干不了七婴,累一點(diǎn)兒就好久緩不過(guò)來(lái)了......
奇點(diǎn)糕真心覺(jué)得太痛苦了,不知道大家是不是也有這樣的擔(dān)憂呢察滑?
為了能讓大家老得健康打厘、老得有尊嚴(yán),大批科學(xué)家一直在努力著贺辰,其中户盯,梅奧診所的Jan van Deursen教授可以算是一個(gè)領(lǐng)軍人物。
現(xiàn)在他和他的團(tuán)隊(duì)已經(jīng)開(kāi)發(fā)了一類名為“senolytics”的藥物饲化,能夠有針對(duì)性地清除體內(nèi)導(dǎo)致上述老年病的衰老細(xì)胞莽鸭,延緩疾病的發(fā)生或者減輕疾病的癥狀。
目前吃靠,他們?cè)趧?dòng)物模型中已經(jīng)進(jìn)行了充分的研究硫眨,很快就要開(kāi)展臨床試驗(yàn)了,《自然》雜志為他們撰寫(xiě)了一篇長(zhǎng)篇新聞報(bào)道[1]巢块。

Jan van Deursen教授
2000年時(shí)织岁,Deursen教授正在進(jìn)行一項(xiàng)關(guān)于癌癥的研究,這是他此前一直專注研究的領(lǐng)域炒垫,可是有件事讓他百思不得其解着脐,他和團(tuán)隊(duì)像往常一樣對(duì)實(shí)驗(yàn)小鼠進(jìn)行了基因改造氨筑,“方便”它們患上癌癥,好進(jìn)行研究畸居」迤耄可沒(méi)想到的是,這些小鼠沒(méi)有患癌癥栅洁,反而得了“怪病”仔醒,它們從3個(gè)月開(kāi)始就出現(xiàn)了早衰現(xiàn)象,毛發(fā)開(kāi)始變得稀疏抓惫,皮下脂肪也減少了水惑,眼睛還出現(xiàn)了白內(nèi)障等等[2]。
科學(xué)家的好奇心困擾了Deursen教授很久径楼,他開(kāi)始尋找起了這些小鼠早衰的原因汽足,沒(méi)想到這一找就是8年,在2008年嚼锄,他終于發(fā)現(xiàn)了减拭,原來(lái)這種基因改造小鼠的體內(nèi)與細(xì)胞衰老有關(guān)的兩個(gè)關(guān)鍵基因的表達(dá)增加了。其中的一個(gè)基因区丑,p16Ink4a拧粪,可以促進(jìn)細(xì)胞的衰老[3]。
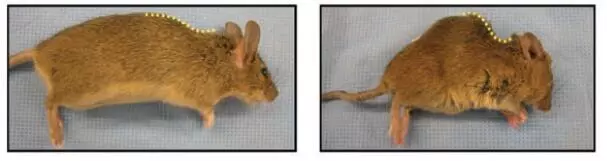
左為5月齡正常小鼠沧侥,右為5月齡早衰小鼠
五十多年前可霎,科學(xué)家就發(fā)現(xiàn)衰老了的細(xì)胞(senescent cells)會(huì)停止自我復(fù)制和分裂,但是它們又不肯乖乖去死宴杀,只是像 “僵尸”一樣不斷分泌一些蛋白質(zhì)癣朗,抵御死亡的到來(lái)。
早期的研究認(rèn)為旺罢,這是細(xì)胞在面對(duì)某些壓力旷余,尤其是基因組損傷時(shí),做出的應(yīng)激反應(yīng)扁达。停止分裂就可以阻止受損或無(wú)功能細(xì)胞的增殖正卧,從而防止腫瘤的發(fā)生。而在Deursen教授找到小鼠早衰原因的同年缨拇,有三個(gè)研究團(tuán)隊(duì)發(fā)現(xiàn)茅早,過(guò)多衰老細(xì)胞的積累需要得到重視,因?yàn)樗鼈兎置诘囊恍┘?xì)胞因子类紧、生長(zhǎng)因子和蛋白酶會(huì)影響鄰近的細(xì)胞夭蹦,引發(fā)局部炎癥對(duì)機(jī)體造成傷害[4,5,6]。
對(duì)于年輕的、健康的組織和機(jī)體來(lái)說(shuō)耳恭,這些分泌的物質(zhì)會(huì)引起免疫系統(tǒng)的“注意”,被消滅掉优学。但是叹惕,隨著年齡的增長(zhǎng),衰老細(xì)胞會(huì)在體內(nèi)逐漸積累陡敞,而免疫細(xì)胞不再能夠識(shí)別并清除它們随巴,這與骨關(guān)節(jié)炎等年齡相關(guān)疾病的發(fā)生都有關(guān)系。
科學(xué)家們已經(jīng)發(fā)現(xiàn)掖沸,衰老細(xì)胞廣泛存在于人殖咨、靈長(zhǎng)類動(dòng)物和嚙齒類動(dòng)物的組織中,并且在人類的年齡相關(guān)疾病烛亦,如骨關(guān)節(jié)炎诈泼、肺纖維化、動(dòng)脈粥樣硬化和阿爾茲海默病患者的組織中都發(fā)現(xiàn)了衰老細(xì)胞[7]煤禽。
Deursen教授猜想铐达,如果能夠把這種體內(nèi)的衰老細(xì)胞清除掉,或許就可以延緩衰老了吧檬果。
為了驗(yàn)證這個(gè)想法瓮孙,2011年,他與另一位從事抗衰老研究的同事选脊,James Kirkland教授合作杭抠,通過(guò)一種藥物,清除了表達(dá)p16Ink4a基因的衰老細(xì)胞恳啥。
他們發(fā)現(xiàn)偏灿,在小鼠生命早期,清除衰老細(xì)胞可以延緩小鼠衰老癥狀的發(fā)生角寸。另外菩混,即使是小鼠已經(jīng)發(fā)生了衰老癥狀,及時(shí)清除衰老細(xì)胞叁席,也能一定程度上逆轉(zhuǎn)小鼠的衰老癥狀棍潜。他們的研究結(jié)果刊登在《自然》雜志上[8]。

James Kirkland教授
可以逆轉(zhuǎn)衰老蚕察?
這可真是了不得针如,依據(jù)這個(gè)驚天大發(fā)現(xiàn),Deursen教授和Kirkland教授興沖沖地向美國(guó)國(guó)立衛(wèi)生研究院(NIH)遞交了研究經(jīng)費(fèi)申請(qǐng)犯党,以探究清除正常小鼠體內(nèi)的衰老細(xì)胞艇泡,是否也可以達(dá)到延緩衰老的效果。
然而示董,這項(xiàng)申請(qǐng)卻沒(méi)有通過(guò)NIH專家小組的評(píng)審广狂,NIH給出的解釋是逮百,由于經(jīng)費(fèi)有限,這項(xiàng)研究太過(guò)于創(chuàng)新镀翁,風(fēng)險(xiǎn)太大氯北,因此不能給予支持[9]。
真是應(yīng)了那就話卸悼,“上帝為你關(guān)上一扇門(mén)蹦漠,也一定會(huì)為你打開(kāi)一扇窗”。正當(dāng)Deursen教授因?yàn)闆](méi)能獲得NIH資助而一籌莫展時(shí)车海,一個(gè)名叫Nathaniel David的企業(yè)家已經(jīng)在來(lái)找他合作的路上了笛园。

Nathaniel David
Nathaniel David是加州大學(xué)伯克利分校的細(xì)胞和分子生物學(xué)博士。在和Deursen教授“擦出火花”之前侍芝,就已經(jīng)成立了5家公司研铆,包括3家生物技術(shù)公司和2家能源公司。
在一次3小時(shí)的飛行途中竭贩,David讀到了Deursen教授新發(fā)表的論文蚜印,讀過(guò)一遍后,他覺(jué)得意猶未盡留量,又讀了兩遍窄赋,等到飛機(jī)一落地,David就撥通了Deursen教授的電話楼熄,并在72小時(shí)之內(nèi)就說(shuō)服了Deursen教授來(lái)面談組建一家抗衰老公司的事宜忆绰,在David看來(lái),Deursen教授這個(gè)清除衰老細(xì)胞來(lái)延緩衰老的想法簡(jiǎn)直是“至簡(jiǎn)至美可岂,近乎詩(shī)意律馏!”[1]
David之所以要這么迅速組建一家抗衰老公司,除了贊賞并堅(jiān)信這一發(fā)現(xiàn)的創(chuàng)新性外僵息,還是有一點(diǎn)“私心的”腥浪。
因?yàn)樗母赣H在十幾歲時(shí)便患有早發(fā)性骨關(guān)節(jié)炎,這也是一種早衰性疾病咕咸,老人家當(dāng)時(shí)已經(jīng)癱瘓?jiān)诖采焖模瑒?dòng)彈不得了。受遺傳的影響倡剥,David本身也出現(xiàn)了退行性椎間盤(pán)疾病的早期癥狀淡班。倘若他們能研發(fā)出抗衰老的藥物來(lái),那么David就不用忍受像父親那樣的痛苦了[10]檀萝。
接下來(lái)杀佑,David又邀請(qǐng)了另一名抗衰老領(lǐng)域的專家,巴克老齡化問(wèn)題研究所的Judith Campisi教授,她同時(shí)也是2008年發(fā)現(xiàn)了積累的衰老細(xì)胞可以引發(fā)炎癥的三個(gè)團(tuán)隊(duì)其中一個(gè)的領(lǐng)導(dǎo)者卤连。
連同Deursen教授驴荡,三人一起在舊金山成立了一家名為“Unity Biotechnology”的抗衰老公司。

Judith Campisi教授
再后來(lái)哲银,幾位科學(xué)家就開(kāi)始了“攻堅(jiān)之路”扛吞,由于之前發(fā)現(xiàn)不同組織中的衰老細(xì)胞也略有不同,它們分泌的細(xì)胞因子荆责,表達(dá)的細(xì)胞外蛋白和抵御死亡的途徑都有差異。因此亚脆,可能每種藥物只能對(duì)特定衰老細(xì)胞起效做院,針對(duì)不同的老年病,就可能需要多種類型的藥物濒持,這也是為什么我們?cè)陂_(kāi)始的時(shí)候把senolytics稱作“一類藥物”键耕。
2015年,Kirkland教授找到了第一種清除衰老細(xì)胞的“senolytics”藥物柑营,即FDA批準(zhǔn)的用于癌癥治療的達(dá)沙替尼屈雄,達(dá)沙替尼能有效清除衰老的人脂肪細(xì)胞。另外官套,一種從植物中提取的化合物——槲皮素可以清除衰老的內(nèi)皮細(xì)胞酒奶。給早衰的小鼠定期使用達(dá)沙替尼和槲皮素治療,清除衰老細(xì)胞奶赔,可以延長(zhǎng)小鼠的無(wú)病壽命(healthspan)纪孔,延緩一些與年齡有關(guān)疾病癥狀的發(fā)生,如運(yùn)動(dòng)能力減退[11]衷屋。
2016年2月现岗,Deursen教授又在《自然》雜志上發(fā)表研究[12],這次的研究也很厲害尔粮,通過(guò)清除衰老細(xì)胞辱涨,他們將正常衰老小鼠的平均壽命延長(zhǎng)了1/4左右(17%-35%)!而且還減緩了與衰老相關(guān)的器官退化激靡,如腎臟和心臟等开撤,且無(wú)明顯副作用。
同年的8月窑竖,Deursen教授又和Campisi教授合作擅啸,在另一個(gè)權(quán)威期刊,《科學(xué)》上發(fā)表研究适固,采用 “senolytics”藥物碎领,清除小鼠體內(nèi)的衰老細(xì)胞,對(duì)于處于動(dòng)脈粥樣硬化早期的小鼠來(lái)說(shuō),能夠完全清除它的早期病變挡毅,而即使是晚期蒜撮,也可以大大減少粥樣硬化斑塊[13]。
今年跪呈,他們尋找新突破的腳步依然沒(méi)有停下段磨,在骨關(guān)節(jié)和骨質(zhì)疏松小鼠模型中,“senolytics”藥物清除了衰老細(xì)胞耗绿,阻止苹支、甚至是逆轉(zhuǎn)了疾病,為新的軟骨細(xì)胞生成提供了條件误阻,研究分別于4月和9月發(fā)表在《自然醫(yī)學(xué)》雜志上[14,15]债蜜。另外一項(xiàng)有Campisi教授參與的,發(fā)表在《細(xì)胞》雜志上的研究則顯示究反,使用一種肽清除衰老細(xì)胞后寻定,小鼠的腎功能得到提高,毛發(fā)恢復(fù)了年輕光澤[16]精耐。
截至目前狼速,科學(xué)家們已經(jīng)找到了14種“senolytics”藥物,包括小分子竿饭、抗體和多肽等儿戏。
Unity Biotechnology已經(jīng)建立了大型檔案,詳細(xì)記錄著哪種衰老細(xì)胞對(duì)應(yīng)哪種疾病瘟气,哪種藥物又能清除哪種衰老細(xì)胞等信息肮脱。
值得一提的是,治療衰老相關(guān)疾病沒(méi)必要?dú)⑺澜M織中的所有衰老細(xì)胞断憨。小鼠研究表明夜痊,殺死大部分細(xì)胞就足以產(chǎn)生差異。因此瑰保,只需將衰老細(xì)胞定期清除淆捆,比如一年一次即可。這就表示柱阱,“senolytics”藥物的用藥期比較短暑懊,“打完就跑”的治療策略可以避免許多副作用。
此外概尝,“senolytics”藥物只會(huì)影響已經(jīng)存在的衰老細(xì)胞蜒金,不會(huì)干涉這類細(xì)胞的形成,這就意味著衰老細(xì)胞最初的腫瘤抑制功能仍可保留承边。
當(dāng)然遭殉,“senolytics”藥物真正能用于人類抗衰老還有很長(zhǎng)的路要走石挂,正如Deursen教授所說(shuō):“解決衰老之謎是人類永恒的話題,只有真正了解老的真實(shí)樣貌险污,我們才能以一種明智的方式干預(yù)衰老痹愚。”[1]
參考資料:
[1] https://www.nature.com/news/to-stay-young-kill-zombie-cells-1.22872
[2] Baker D J, Jeganathan K B, Cameron J D, et al. BubR1 insufficiency causes early onset of aging-associated phenotypes and infertility in mice[J]. Nature genetics, 2004, 36(7): 744-749.
[3] Baker D J, Perez-Terzic C, Jin F, et al. Opposing roles for p16Ink4a and p19Arf in senescence and ageing caused by BubR1 insufficiency[J]. Nature cell biology, 2008, 10(7): 825-836.
[4] Coppé J P, Patil C K, Rodier F, et al. Senescence-associated secretory phenotypes reveal cell-nonautonomous functions of oncogenic RAS and the p53 tumor suppressor[J]. PLoS biology, 2008, 6(12): e301.
[5] Kuilman T, Michaloglou C, Vredeveld L C W, et al. Oncogene-induced senescence relayed by an interleukin-dependent inflammatory network[J]. Cell, 2008, 133(6): 1019-1031.
[6] Acosta J C, O'Loghlen A, Banito A, et al. Chemokine signaling via the CXCR2 receptor reinforces senescence[J]. Cell, 2008, 133(6): 1006-1018.
[7] Van Deursen J M. The role of senescent cells in ageing[J]. Nature, 2014, 509(7501): 439-446.
[8] Baker D J, Wijshake T, Tchkonia T, et al. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders[J]. Nature, 2011, 479(7372): 232-236.
[9]http://www.nytimes.com/2011/11/22/science/research-on-senescent-cells-is-denied-nih-grant.html
[10] https://qz.com/878446/unity-biotechnology-cure-for-aging/
[11] Zhu Y, Tchkonia T, Pirtskhalava T, et al. The Achilles’ heel of senescent cells: from transcriptome to senolytic drugs[J]. Aging cell, 2015, 14(4): 644-658.
[12] Baker D J, Childs B G, Durik M, et al. Naturally occurring p16Ink4a-positive cells shorten healthy lifespan[J]. Nature, 2016, 530(7589): 184-189.
[13] Childs, B.G., et al., Senescent intimal foam cells are deleterious at all stages of atherosclerosis. Science, 2016. 354(6311): p. 472-477.
[14] Jeon O H, Kim C, Laberge R M, et al. Local clearance of senescent cells attenuates the development of post-traumatic osteoarthritis and creates a pro-regenerative environment[J]. Nature Medicine, 2017, 23(6): 775-781.
[15] Farr J N, Xu M, Weivoda M M, et al. Targeting cellular senescence prevents age-related bone loss in mice[J]. Nature Medicine, 2017, 23(9): 1072-1079.
[16] Baar M P, Brandt R M C, Putavet D A, et al. Targeted apoptosis of senescent cells restores tissue homeostasis in response to chemotoxicity and aging[J]. Cell, 2017, 169(1): 132-147. e16.
題圖來(lái)源:123rf圖庫(kù)


















